|
|

|
|
|
|
|
|

|
|
|
|
 하이브리드 단분자 기술 개발
하이브리드 단분자 기술 개발  비표준 DNA 연구
비표준 DNA 연구  염색질 연구
염색질 연구  항암제 작용원리 규명
항암제 작용원리 규명
 iSCAT장치 개발
iSCAT장치 개발  Label-free 세포관찰
Label-free 세포관찰  입자추적
입자추적
|
|

|
|
|
|
|
|

|
|
하이브리드 단분자 생물리 기술 개발
|
|

|
|
|
|
프렛(FRET: Fluorescence Resonance Energy Transfer)은 두 형광 분자 간에 일어나는 에너지 전달 현상을 가리키며, 이로 인해 방출 형광 신호의 파장이 길어진다. 한 형광분자(주개분자, donor)가, 에너지를 받아 들뜨게 되면 곧 형광이 방출되는데, 이 주개분자의 방출스펙트럼과 겹치는 흡수스펙트럼을 갖는 다른 형광분자(받개분자, acceptor)가 가까이 있으면 거기로 에너지가 전달되어 대신 형광을 내게 된다. 에너지 전달 효율은 주개분자와 받개분자 사이의 거리에 민감해, 수 나노미터 범위에 걸쳐 크게 변하며, 약 5 나노미터 거리에서 전달 효율이 50%가 된다. 단분자 프렛(smFRET: single-molecule FRET)은 프렛을 개별 쌍에 대해서 측정하는 기술이다. 이 기술은 개별 분자의 사건을 실시간으로 추적(real-time tracking)하므로, 이질성(heterogeneity without ensemble averaging)을 드러낼 수 있고, 동력학적 정보(dynamic information)를 획득할 수 있는 장점도 지닌다.
한편 자성 트위저 (magnetic tweezers) 기술은, 특정 생체 분자(주로 DNA)에 자성을 띄는 구슬을 달아 자석을 이용하여 생체분자를 잡아당기거나 비틀어 줌으로써 해당 분자의 역학적 성질을 측정하는 기술이다.
|

< MT-FRET 융합 장치 >
|
구슬의 영상을 분석하여 구슬의 높이, 즉 생체분자 말단의 위치를 측정할 수 있으며, 최대 수십 pN의 힘을 분자에 가할 수 있다. 이를 통해 분자의 길이 변화를 수 나노미터 이내로 측정할 수 있다. 이 두 기술을 융합한 기술이 <그림>에 있는 MT-FRET 장비이다. 이 기술은, 분자 결합, 효소 작용, 역학적 제어 등에 의한 생체분자의 구조 변화를, (i) 구슬 영상 분석으로 파악한 분자의 양끝거리 변화와 (ii) FRET 신호 검출로 파악한 국소 영역의 길이 변화로 측정할 수 있는 기술이다.
|
이들 신호 및 영상의 동시 관측을 통해 복합적인 정보를 획득할 뿐 아니라, 동역학적 성질을 깊이 있게 연구할 수 있다. 본 연구실에서는 역학적, 화학적, 생물학적 조건을 변화시킬 때 다양한 구조의 DNA 분자가 나타내는 물성 변화를 정량적으로, 동적으로 파악하는 연구를 수행하고 있다.
|
|
|

|
|

|
|
비표준 DNA의 단분자 연구
|
|

|
|
|
|
|
1953년에 왓슨과 크릭은, 유전정보를 전달하는 DNA가 이중나선 구조를 가짐을 학술지 '네이처'에 발표하였다. 왓슨과 크릭이 처음 제안한 표준 DNA 구조는 B-DNA라고 불리는데(그림 a) 이 후 다양한 구조의 DNA가 발견되었다. 표준 DNA의 특성 연구는 광범위하게 이뤄졌지만, 비표준 DNA는 아직 밝혀지지 않은 것이 많다. 분자생물학, 생화학 실험실에서 수행하는 실험들은 Avogadro 수에 비할 만큼 많은 수의 분자를 이용한 ‘bulk’ 실험이기 때문에 분자들의 평균적인 경향성은 알 수 있지만 분자 간 개별 특성이나, 짧은 시간에만 관찰 가능한 성질, 개별 분자의 동역학적 성질은 알기 어려웠다. 본 연구실의 단분자 FRET, magnetic tweezers 기술은 개별 분자의 물성 연구에 적합하며, 이를 사용하여 비표준 DNA의 역학적 특성을 연구할 수 있다. 현재 연구실에서 연구 중인 비표준 DNA는, 삼중나선 H-DNA, B-DNA와 반대인 왼나사 방향 이중나선 Z-DNA, 사이토신 4중 복합체인 i-motif 등이 있다.
|
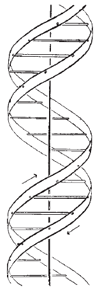
<그림 a>
|

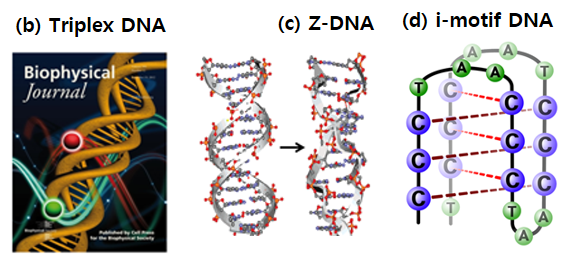
< 그림 b, c, d >
*Triplex DNA 연구
삼중나선 DNA는 특정 서열이 산성 조건, 높은 염도 하에서 나타내는 구조이다 (그림 b). B-DNA는 왓슨-크릭 결합을 통해 두 가닥의 DNA가 결합하지만 삼중나선 DNA는 이중나선 DNA에 추가로 단일가닥의 DNA가 Hoogsteen 결합을 하여 형성된다. 삼중나선 DNA는 구조적 특이함 외에도, 화학센서로의 활용, Friedreich Ataxia 와 같은 유전병과의 연관성으로 인해 많은 관심을 받고 있다. 본 연구실에서는 단분자 FRET기술을 이용하여 삼중나선 DNA의 동역학적 특성을 연구하고 있다.
*Z-DNA 연구
왼나사 방향 이중나선 Z-DNA는 그 특이한 구조와 생물학적 역할의 가능성으로 인해 많은 관심을 받아왔다 (그림 c). Z-DNA는 음의 초나선도(negative supercoiling)에 의해 안정적으로 존재할 수 있다고 알려져 있다. 아직 B-Z전이에 대한 자세한 이해는 부족한 상태이다. 본 연구실에서는 단분자 FRET과 magnetic tweezers의 융합 장치를 이용하여 장력과 초나선도를 제어한 상태에서 짧은 CG, TG 반복 서열에서 일어나는 B-Z 전이를 연구하였다.
* i-motif 연구
사이토신(cytosine, C)이 많은 DNA는 i-motif라는 독특한 구조가 형성될 수 있음이 알려져 있다 (그림 d). 인간 염색체의 끝부분에 텔로미어(telomere)라고 불리는 사이토신이 많은 서열이 있는데 세포가 한번 분열할 때마다 50~100 bp 정도의 텔로미어가 사라진다고 알려져 있고 계속 짧아지다 보면 언젠가는 세포는 더 이상 분열을 하지 못하고 사멸하게 된다. 반면에 텔로미어가 짧아지지 않는다면 세포는 죽지 않고 장수하게 되는데 사멸하지 않고 분열만 하는 극단의 세포가 암세포라고 할 수 있다. 우리 연구실에서는 인간 텔로미어 서열에 있는 i-motif 구조의 역학적 특성을 연구하고 있다.

Sequence-dependent cost for Z-form shapes the torsion-driven B-Z transition via close interplay of Z-DNA and DNA bubble. Sook Ho Kim et al. Int. J. Mol. Sci., 2021
Z-DNA as a Tool for Nuclease-Free DNA Methyltransferase Assay. Sook Ho Kim et al. NAR, 2021
Unveiling the pathway to Z-DNA in the protein-induced B–Z transition. Sook Ho Kim et al. NAR, 2018
Destabilization of i-Motif by Submolar Concentrations of a Monovalent Cation. Sung Eun Kim et al. JPCB, 2014
Kinetics of the Triplex-Duplex Transition in DNA. Il-Buem Lee et al. BJ, 2012
Direct observation of the formation of DNA triplexes by single-molecule FRET measurements. Il-Buem Lee et al. CAP, 2012
Minute negative superhelicity is sufficient to induce the B-Z transition in the presence of low tension. Mina Lee et al. PNAS, 2010
|
|
|

|
|

|
|
염색질 연구
|
|

|
|
|
|
DNA는 생명현상의 방대한 (서열) 정보를 모두 지니고 있는 생체물질이다. 세포는 DNA를 매우 작게 응축하여 염색질(chromatin)이라 불리는 상태로 관리한다. 염색질은 8개의 '히스톤' 단백질에 DNA가 약 2바퀴씩 감긴 형태를 기본 구조로 하며 이를 '뉴클레오좀'이라 부르며 뉴클레오좀을 추가로 응축하여 염색체를 형성한다. 세포 분열을 위해 DNA가 복제되어야 하는데, 염색질 상태의 DNA로부터 정보를 읽고 복사하기 위해 뉴클레오좀 구조가 와해되어야 한다. 한편, 염색질의 응축도에 따라 발현되는 유전자의 종류가 달라지는데, 이것이 분화되어 세포의 종류가 결정되는 핵심 원리이다. 서열 외적인 요인에 따른 유전자 발현 양상의 차이를 연구하는 학문을 '후생 유전학(epigenetics)'이라 부른다.
우리 연구실에서는 Nucleosome Assembly Protein 1 (NAP1)이라는 히스톤 샤페론으로 단일 DNA 분자에 염색질을 만들어 그 역학적 성질을 자성 트위저로 연구하고 있다. 이렇게 만든 염색질은 그 역학적 특성이 일반 DNA (그림 c)와 다름을 알 수 있었다. (그림 d). 이를 기반으로 다양한 조건에서 역학적 특성이 어떻게 바뀌는가에 대해 연구 중이다.
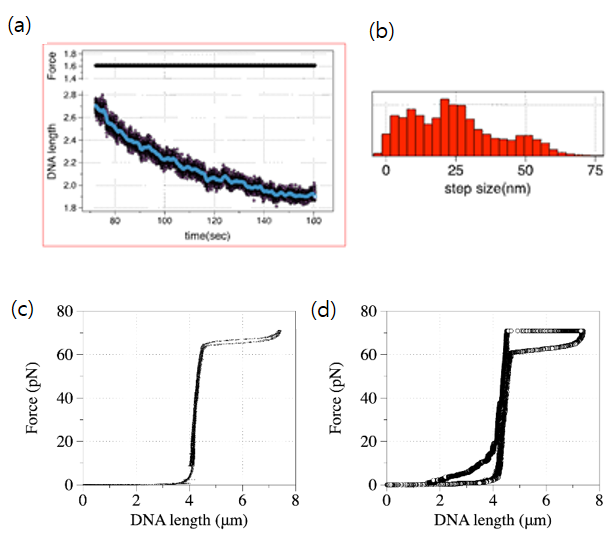
< 그림 a, b, c, d >
|
|
|

|
|

|
|
항암제(Cisplatin, Curaxin) 작용 원리 규명
|
|

|
|
|
|
인류는 암을 극복하기 위해 끊임없이 투쟁하고 있다. 화학물질(약)을 사용하는 방법도 오래 전부터 시도되며 꾸준히 발전하고 있다. 암과의 전쟁에서 획기적인 전환점을 마련한 것이 백금계 항암제인 시스플라틴(cisplatin)의 발견이었다. 시스플라틴은 DNA에 직접 결합하여 구부리고 비틀어 줌으로써 손상을 일으키고 이 손상은 복구되기 어려워 복제가 빨리 일어나고 있는 암세포에 치명타를 안긴다. 발암물질이지만, 암세포가 선택적으로 먼저 사멸하는 효과를 통해 역설적으로 가장 강력한 항암제가 되었다.
우리는 자성트위저를 이용해 개별 DNA 분자를 당겨주거나 비틀어주는 단분자 역학 실험만으로 시스플라틴의 결합도를 측정하는 기술을 개발하였고, 앞서 언급한 염색질에 미치는 효과를 연구함으로써 시스플라틴의 항암 원리를 밝히는 연구를 진행 중이다.
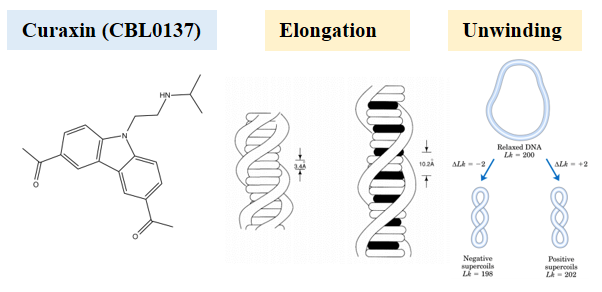

Cisplatin fastens chromatin irreversibly even at a high chloride concentration. Hyeon-Min Moon et al. NAR, 2021
In situ analysis of cisplatin binding to DNA: the effects of physiological ionic conditions. Jin-Sung Park et al. PCCP, 2012
Temperature Dependence of DNA Elasticity and Cisplatin Activity Studied with a Temperature-Controlled Magnetic Tweezers System. Jin-Sung Park et al. JKPS, 2008
The elastic property of a single DNA molecule cross-linked by cisplatin: a magnetic tweezers study. Jin-Sung Park et al. JKPS, 2008
|
|
|

|
|

|
|
간섭산란현미경(iSCAT) 개발
|
|

|
|
|
|
간섭-산란 현미경 (iSCAT: Interferometric-scattering microscopy)은 빛의 간섭을 이용하여 가시광 파장보다 작은 사물을 감지하고 영상화하는 현미경 기술이다. 빛의 간섭이란, 서로 다른 위상을 가진 두 개 이상의 파동들이 중첩되어 나타나는 현상으로, 위상차에 따라 보강 또는 상쇄 간섭이 발생한다. 간섭-산란 현미경에서는 사물에서 산란된 빛과 유리/물 경계면에서 반사된 빛의 간섭으로부터 수~수십 나노미터 크기의 사물을 검출해내는 기술이다.
전통적인 명시야(bright-field) 현미경으로 관측 가능한 사물의 크기는 빛의 회절 한계 이내로 제한된다. 형광 기술의 발달로 광학적 분해능의 한계를 넘어 영상을 얻는 것이 가능하게 되었으며, 이를 초고해상도 형광 현미경 기술(Super-resolution fluorescence microscopy)이라고 한다. 하지만, 제한된 관측시간, 과도한 표지에 의한 광 신호 포화 및 광독성에 의한 생물학적 시료의 손상은 형광 기술이 해결해야 하는 문제점으로 남아있다. 이러한 측면에서 간섭-산란 현미경은 높은 감도로 비표지(label-free) 관찰이 가능하기에 형광 현미경 기술의 한계를 극복하는 기술이 될 수 있고, 레일리 산란 영역에 해당하는 작은 사물에 대한 직관적인 관측을 가능하게 할 뿐만 아니라, 고속 영상 촬영이 가능하기에 큰 잠재력을 가진 기술이라고 할 수 있다.

Three dimensional interferometric scattering microscopy via remote focusing technique. Il-Buem Lee et al. Optic Lett, 2020
Interferometric Scattering Microscopy with Polarization-Selective Dual Detection Scheme: Capturing the Orientational Information of Anisotropic Nanometric Objects. Il-Buem Lee et al. ACS Photonics, 2017
|
|
|

|
|
|
|

|
|
iSCAT 현미경을 이용한 세포 관찰
|
|

|
|
|
|
최근까지 형광 현미경 기반 세포 이미징 기법은 세포의 초미세 기관들의 위치와 구조를 가장 정확하게 확인할 수 있는 방법으로 널리 이용되고 있다. 그러나, 형광 분자들을 세포 내부로 주입하거나 형광 단백질을 발현시키는 과정에서 세포 내부의 구조 및 기능 변화를 유발하는 단점이 있다. 뿐만 아니라, 형광 분자들은 결국 시간이 지남에 따라 산화되어 형광 분자로서의 기능을 잃어버리기 때문에 관찰 가능 시간 또한 매우 짧다. 이러한 형광 이미징의 기술적 한계점을 극복하기 위한 일환으로, 최근 다양한 방식의 비표지 이미징 기법들의 개발되고 있다. 본 연구진은 세포를 구성하고 있는 세포 지질막과 내부 소기관들로부터 산란되어 나오는 매우 약한 신호의 빛을 세포가 부착된 유리 바닥면에서부터 일정하게 반사되어 나오는 상대적으로 강한 빛과 간섭을 일으켜서 형광 분자의 도움 없이 세포의 미세기관들을 고해상도로 관찰할 수 있는 iSCAT 현미경 개발에 성공했다(그림 a).
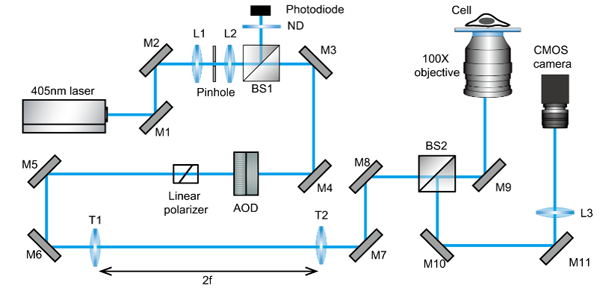
<그림 a. iSCAT 현미경의 개략도>
타 비표지 기술로 관찰이 어려웠던 세포 둘레의 사상위족(filopodium)의 미세구조들을 iSCAT 기술로 선명하게 관찰할 수 있었고, 세포 내부 소기관들을 구성하고 있는 다층 지질막 구조를 관찰하는 데 성공함으로써, iSCAT 현미경이 기존 광학 현미경보다 훨씬 우수한 공간 분해능을 가짐을 증명했다.

< 그림 b. 위상차 현미경을 이용한 세포 영상(A-C)과 고해상도 iSCAT 현미경 세포 영상(D-F). >

Label-free and live cell imaging by interferometric scattering microscopy. Jin-Sung Park et al. Chemical Science, 2020
Fluorescence-Combined Interferometric Scattering Imaging Reveals Nanoscale Dynamic Events of Single Nascent Adhesions in Living Cells. Jin-Sung Park et al. JPCL, 2020
|
|
|

|
|
|
|

|
|
iSCAT을 이용한 생체 분자 관찰
|
|

|
|
|
|
|
대부분의 생체 분자의 크기는 수십 nm 이하이다. 광학 현미경으로 관찰하기 어렵기 때문에 전자 현미경, 형광 현미경 등을 사용하여 관찰한다. 하지만 이들 방법은 생체 분자를 자연적인 상태에서 관찰할 수 없기 때문에 여러 한계를 갖는다. 따라서 생명 현상을 왜곡없이 이해하기 위해서 작은 생체 분자를 표지 없이 고해상도로 빠르게 측정하는 방법이 필요하다.
iSCAT 기술은 회절 한계보다 작은 크기의 입자를 표지 없이 관찰하기 위해 개발되었다. 나노 미터 수준의 크기를 가진 입자는 레일리 산란을 일으킨다. 일반적으로 레일리 산란광은 매우 약해서 측정하기 어렵다. iSCAT 기술은 매우 약한 산란광을 측정할 수 있다. 산란광의 세기는 입자의 종류, 질량, 표면적 등에 따라 달라지기 때문에 신호를 올바르게 해석하면 관찰하는 입자의 상태를 알 수 있다.
대부분의 DNA 관찰 실험은 형광 분자를 DNA에 붙여 형광 신호를 측정함으로써 간접적으로 DNA에 대한 정보를 얻는다. 하지만 형광 기술은 다양한 한계를 갖기에 비표지로 분자를 추적할 수 있다면 매우 유익할 것이다. iSCAT으로 바닥에 부착시킨 DNA를 실시간으로 관찰함으로써 DNA의 질량을 측정할 수 있고, 질량 변화를 측정함으로써 DNA에 다른 분자가 결합하는 것을 관찰할 수 있어 다양한 활용이 기대된다.
|

< 그림 a. iSCAT 장치 >
|
|
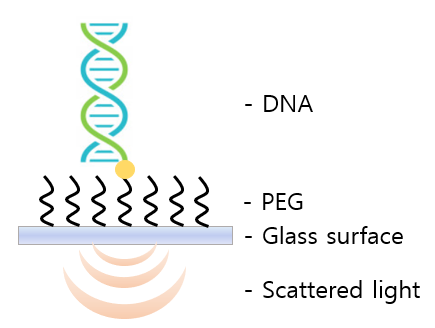
<그림 b. DNA 부착의 방법>
|
|
|
|
|
|

|
|
|
|
|
|
|
|
![]()
![]()
